Attaquons sans plus attendre, si vous le voulez bien, ce deuxième chapitre.
Nous progressons doucement vers notre but : comprendre la rigidité cadavérique.
À la fin de ce chapitre vous serez en mesure de :
- Comprendre la relation anatomique liant un nerf et son muscle (notion de jonction neuromusculaire) ;
- Comprendre ce qu’il se passe dans le nerf et décrire la nature de l’information nerveuse (notion de potentiel d’action) ;
- Comprendre ce qu’il se passe dans le muscle lorsqu’il se contracte suite à son activation par le nerf (notion de contraction).
L’assimilation du chapitre précédent est un pré-requis indispensable.
- Le nerf donne l'ordre au muscle de se contracter
- L'information nerveuse dans le nerf transite vers le muscle
- La contraction musculaire : le couplage excitation-contraction
Le nerf donne l'ordre au muscle de se contracter
Rappelez-vous qu’un nerf est un ensemble ordonné d’axones. Et de l’autre côté nous avons le muscle, ensemble ordonné de cellules musculaires. Chaque axone peut aller se connecter à une ou plusieurs cellules musculaires par l’intermédiaire d’une synapse particulière (contact entre un axone et la cellule musculaire) appelée jonction neuromusculaire. Mais chaque cellule musculaire ne reçoit qu’un seul axone.
Nous venons également de définir la notion d'unité motrice. Une unité motrice est constituée d’un motoneurone (= neurone moteur, donc avec son axone ensuite) et de toutes les fibres musculaires que celui-ci innerve (donc une seule fibre ou plusieurs sur la base de la définition ci-dessus).
Par extension on définit la notion de myotome. Un myotome est constitué de l’ensemble des motoneurones d’un nerf spinal et de toutes les fibres musculaires qu’ils innervent.
La différence entre ces deux définitions tient donc au nombre de motoneurones considérés.
Ces neurones sont appelés motoneurones (ou neurones moteurs) car ils véhiculent une information motrice, en direction des muscles effecteurs (ici le muscle strié squelettique pour notre sujet d’étude). À l’inverse les neurones sensitifs partent des organes des sens ou de la peau pour véhiculer une information de sensation vers le système nerveux central.
Il y a donc connexion macroscopique entre un nerf et son muscle. Et qui dit connexion macroscopique dit connexion microscopique, et c’est encore ce qui va nous intéresser en fait.
Grosso-modo si nous voulons bouger notre bras nous n’avons qu’à penser à le faire. Mais en vrai l’information part du cortex cérébral, descend vers la moelle épinière et transite par un nerf spinal pour atteindre le muscle cible, ici celui du bras. L’information nerveuse quitte la moelle épinière à différents niveaux, assez haut pour se diriger vers le bras, plus bas pour un muscle de la jambe par exemple.
Cela explique que des lésions à la moelle épinière peuvent rendre un sujet paraplégique ou tétraplégique. En fonction de la localisation de la lésion les deux membres inférieurs uniquement seront touchés ou bien les quatre membres. Si la lésion est assez basse le message nerveux pourra circuler dans le haut de la moelle épinière et atteindre les bras mais pas les jambes car il sera interrompu avant. Si la lésion est assez haute, le message nerveux sera interrompu tôt dans son parcours et ne pourra ni atteindre les membres supérieurs ni les membres inférieurs. Il peut y avoir perte de motricité et/ou de sensation en fonction de l’étendue des lésions.
Ainsi si un nerf se connecte à son muscle il est essentiel de comprendre qu’au niveau microscopique c’est aussi un axone de motoneurone qui se connecte à une ou plusieurs fibres musculaires du muscle cible. L’ensemble des axones du nerf innerve ainsi l’ensemble des fibres musculaires du muscle et permet la contraction simultanée des fibres musculaires dans le muscle. Il en résulte que la "contraction microscopique" de l’ensemble des fibres musculaires du muscle se traduit par une "contraction macroscopique" du muscle, visible à l’oeil nu.
Il existe deux types de contraction pour un muscle : une contraction qui réduit la longueur du muscle et produit le mouvement, elle est appelée contraction phasique isotonique (isotonique car même tonus mais la longueur du muscle change) et une contraction qui ne réduit pas (ou peu) la longueur du muscle et ne produit pas de mouvement, elle est appelée contraction tonique isométrique (isométrique car même longueur mais le tonus du muscle change).
L'information nerveuse dans le nerf transite vers le muscle
Depuis tout à l’heure nous parlons d’"information nerveuse", "message nerveux" mais qu’est-ce que c’est concrètement ?
Dans de nombreuses vidéos on représente cela par une sorte d’étincelle bleue qui se propage le long d’un nerf, activant comme par magie le muscle. Cela n’est pas la représentation de la réalité mais permet de rendre compte de la nature du message qui est donc électrique.
Ce n’est rien d’autre que de l’électricité qui circule dans les nerfs et permet la contraction des muscles.
Ce que nous vous proposons de faire c’est de repartir de notre cortex cérébral dans le cerveau et aller jusqu’à la jonction neuromusculaire, puis de décrire comment naît ce message nerveux et surtout ce que c’est concrètement.
Du cortex cérébral jusqu’à la moelle épinière : la voie cortico-spinale
Nous vous voyons faire les grands yeux face à ce gros mot qu’est cortico-spinale. 
Mais ne vous inquiétez pas, c’est en fait simple : "cortico" se réfère au cortex cérébral et "spinale" à la moelle épinière, ce terme indique le sens du trajet du message nerveux, il part du cerveau pour aller jusqu’à la moelle épinière.
C’est la voie des "mouvements volontaires". Vous avez sans doute entendu cette phrase plusieurs fois : "l’hémisphère gauche contrôle la partie droite du corps et l’hémisphère droit contrôle la partie gauche du corps", c’est vrai. Les neurones situés dans l’hémisphère gauche, au niveau du cortex cérébral, descendent jusqu’à la moelle épinière mais se retrouvent sur le côté droit de la moelle épinière, et iront donc innerver les muscles du bras droit ou de la jambe droite par exemple. Cela est dû à une particularité anatomique au niveau du bulbe rachidien du tronc cérébral (sous le cerveau et au-dessus de la moelle épinière), à ce niveau les axones issus des corps cellulaires des neurones du cortex cérébral se croisent et se dirigent vers l’autre partie du corps, dite controlatérale : ce croisement est appelé décussation.
La nature du message électrique : des ions
Dans l’axone des neurones corticaux (pour rappel ceux qui vont jusqu’à la moelle épinière) le message nerveux est en fait nommé potentiel d’action.
Et c’est là que ça devient intéressant et que ça va un peu se corser, accrochez-vous car c’est crucial pour comprendre la suite. 
Les scientifiques ont observé que deux ions principaux sont impliqués dans la genèse du potentiel d’action. Les ions sont des atomes ayant gagné ou perdu un ou plusieurs électron(s) et sont donc des espèces chargées négativement ou positivement respectivement.
Toute cellule vivante possède une membrane plasmique et il y a une différence de charges de part et d’autre de celle-ci (appelée différence de potentiel). En plaçant une microélectrode d’enregistrement d’une part dans le milieu intracellulaire et d’autre part dans le milieu extracellulaire on observe, pour un neurone, la valeur de -60mV. Cela signifie que l’intérieur de la cellule est chargé négativement par rapport à l’extérieur de la cellule, au proche de la membrane plasmique. C’est ce qui est observé pour un neurone au repos. Même si vous ne comprenez pas ce que signifie "au repos" actuellement, vous le saurez dans quelques lignes.
L’intérieur d’une cellule possède plus de potassium que l’extérieur mais moins de sodium que l’extérieur. Cela peut vous sembler être un détail inutile mais c’est très très important pour comprendre la suite ! Notez-le bien quelque part !
Et sans surprise vous comprenez que les deux ions impliqués dans le potentiel d’action dont nous parlions sont en réalité le potassium K+ et le sodium Na+. Il s’agit alors en fait de cations car chargés positivement.
Le potentiel d’action comporte toujours 3 phases bien identifiées : (1) une phase dite de dépolarisation où la valeur du potentiel de membrane devient plus grande que -60mV (ce n’est donc plus le repos), par exemple on passera à -30mV, (2) une phase dite de repolarisation où la valeur du potentiel de membrane revient à sa valeur initiale (-60mV) et enfin (3) une phase dite d’hyperpolarisation dans laquelle la valeur du potentiel de membrane "descend plus bas" que sa valeur initiale (-80mV par exemple).
Les tracés d’électrophysiologie typiques d’un potentiel d’action, pour un neurone, sont donc de la forme suivante :
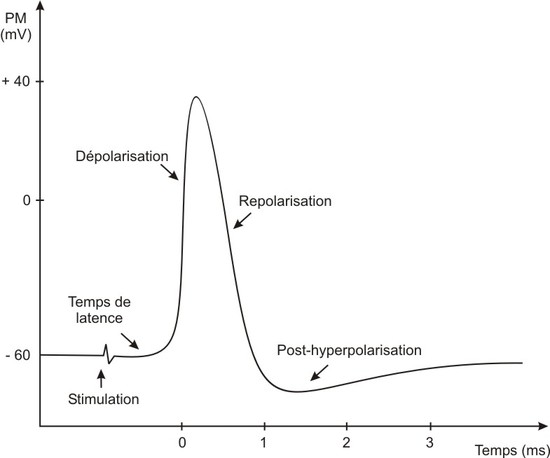
Vous voyez qu’en réalité la valeur du potentiel membranaire du neurone devient même positive lors de la phrase de dépolarisation, allant jusque +30mV. C’est le cas in-vivo et ce qu’il se passe en vrai. L’amplitude d’un potentiel d’action est donc de +90mV (passage de -60mV à +30mV). On considère parfois qu’elle est de +100mV si on prend pour potentiel de repos -70mV au lieu de -60mV.
Mais quel ion intervient à quel moment dans le potentiel d’action ?
Bonne question. Il faut maintenant savoir qu’est-ce qui est responsable de ce passage de -60mV à +30mV et donc de cette dépolarisation. Elle ne va pas survenir par magie n’est-ce pas ? 
Si cette valeur devient plus positive c’est donc que soit des charges négatives sont sorties de la cellule soit que des charges positives sont entrées dans la cellule ou une combinaison des deux. Il ne peut pas s’agir d’une sortie de charges négatives car nous ne vous avions parlé que de cations jusqu’ici et nous vous avions dit que seuls deux cations intervenaient dans le potentiel d’action : le sodium et le potassium.
Ce n’est donc pas non plus une combinaison des deux, c’est donc forcément une entrée de charges positives et donc de cations qui dépolarise notre membrane.
Mais s’agit-il d’une entrée de potassium ou de sodium ?
Ahahah ! Vous ne savez pas hein ? 
Pour le savoir nous vous proposons une expérience historique, on va un peu faire travailler nos méninges !
Le voltage-clamp : une technique d’électrophysiologie merveilleuse
Des scientifiques ont étudié le potentiel d’action et ont, comme nous, voulu savoir quel ion intervenait à quel moment lors de la création du potentiel d’action. Pour cela ils ont travaillé sur l’axone géant de Calmar, avec l’ancien matériel il était plus facile de travailler sur du gros volume.
Ici une technique d’électrophysiologie va nous servir, il s’agit du voltage-clamp ou voltage imposé. Cette technique va nous permettre d’imposer la valeur du potentiel de membrane que nous voulons à notre cellule. Par exemple au lieu de -60mV on va pouvoir mettre 0mV.
Mais pourquoi faire cela ? À quoi ça sert ? Quel rapport avec ce qu’on veut faire ???
Pas d’inquiétudes ! Vous allez vite le savoir. En fait les ions ne rentrent ou ne sortent pas comme ça des cellules. Une membrane plasmique c’est quoi ? Ce sont des lipides essentiellement, et ils ne laissent pas passer les espèces chargées comme les ions. Donc pour que nos ions sortent ou entrent des cellules ils doivent passer dans des espèces de tunnel les isolant du reste de la membrane plasmique, ces tunnels prennent l’ion depuis l’intérieur de la cellule et le jette vers l’extérieur de la cellule ou l’inverse. Ces tunnels sont en fait des protéines, comme ils traversent toute la membrane plasmique ils sont dits trans-membranaires, ce sont donc des protéines transmembranaires. Elles sont plus connues sous le nom de canaux ioniques et en fonction de l’ion qu’ils laissent passer ils portent un nom spécifique : canaux potassique pour le potassium, canaux sodique pour le sodium…
Ces canaux sont aussi appelés en fonction du mode de leur ouverture, ils peuvent donc être fermés (l’ion ne passe pas) ou ouvert (l’ion passe). Si c’est la valeur du potentiel de membrane qui conditionne leur ouverture alors ils seront dits canaux voltage-dépendant, car ils dépendront de la valeur du potentiel de membrane (du voltage).
Alors pourquoi vouloir imposer 0mV à la place de -60mV ? Parce que les canaux que nous étudions (potassique et sodique) ne sont pas ouverts à -60mV, il faut donc dépolariser la membrane pour les ouvrir. Ils sont alors voltage-dépendants selon la définition posée.
Et pourquoi les ouvrir donc ? Car on veut savoir qui du potassium ou du sodium participe à la dépolarisation de la membrane, rappelez-vous !
Mais cela va devenir plus évident pour vous avec notre expérience.
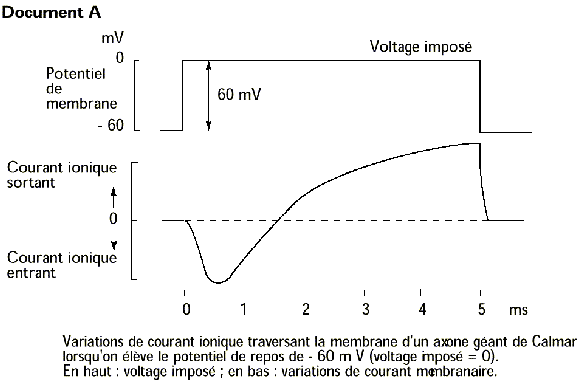
Dans cette première expérience on impose 0mV comme potentiel de membrane (au lieu des -60mV au repos). Ce qui est nouveau pour vous c’est la figure du bas qui montre l’enregistrement des courants au niveau de la cellule lorsque l’on est à 0mV.
Première chose : lorsque des ions entrent ou sortent du neurone via leurs canaux ioniques cela génère un mouvement d’ions (normal jusque là), ce mouvement d’ions est à l’origine d’un courant.
Comme ce courant fait intervenir un mouvement d’ions il est qualifié de courant ionique tout simplement.
Mais pourquoi sortant ou entrant ? C’est en rapport avec le fait que l’ion sort ou entre dans la cellule. Par convention un courant entrant est négatif (tracé orienté vers le bas, sous 0, comme ici) et un courant sortant est positif (tracé orienté vers le haut).
C’est l’inverse pour les anions ! Prenons le cas du chlorure Cl-. Si Cl- entre dans le neurone alors on parlera bien de courant entrant mais ce dernier sera positif. Si Cl- sort du neurone le courant sera sortant mais sera négatif. Moyen mnémotechnique : la dépolarisation est une entrée de charges positives, donc si courant entrant = négatif il faut lier ceci au fait que négatif = apport de charges + dans la cellule.
Ainsi pour un anion l’apport de charges + dans la cellule revient en fait à sortir des charges - de la cellule et donc à sortir l’anion de la cellule, donc dans ce cas négatif = courant sortant.
On peut tirer une chose de cette première expérience : on voit que quand on est à 0mV il y a successivement un courant entrant négatif et un courant sortant positif. Comme il s’agit de cations il y a alors successivement entrée et sortie de cations. Sans nous mouiller on peut d’ores et déjà dire que c’est la sortie de cations qui est responsable de la repolarisation dont nous parlions, puisqu’on rabaisse la valeur du potentiel de membrane quand on est à +30mV.
Mais alors qui intervient pour la dépolarisation ? Une entrée de sodium ou de potassium ? Et pour la repolarisation ? Une sortie de sodium ou de potassium ? Ce n’est toujours pas résolu ça !
Pour le savoir on va faire deux autres expériences, avec du poison ! Oui oui, vous avez bien lu, du poison ! 
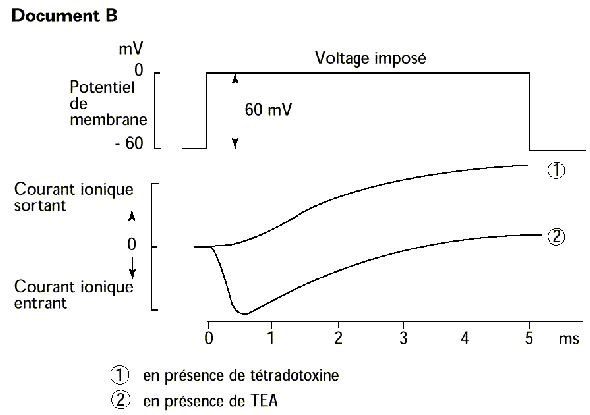
Dans l’expérience 2 on obtient la courbe numérotée 1. En fait les scientifiques ont utilisé un poison extrait d’un certain poisson (ça rime en plus, matez-moi ça  ) appelé Tétrodon. Il y a déjà eu ainsi des cas d’empoisonnements au Japon car le poisson était mal préparé, il restait un peu de la toxine. Si un jour vous mangez des sushis faîtes donc très attention.
) appelé Tétrodon. Il y a déjà eu ainsi des cas d’empoisonnements au Japon car le poisson était mal préparé, il restait un peu de la toxine. Si un jour vous mangez des sushis faîtes donc très attention.
Ce poison porte le doux nom de tétrodotoxine (mal orthographié d’ailleurs sur le document).
Sa particularité est d’inhiber les canaux sodiques voltage-dépendant. Ainsi lorsque les scientifiques ont appliqué ce poison au neurone et à 0mV, ils ont obtenu le tracé de la courbe 1.
Ils ont ensuite utilisé un deuxième poison (ça y va fort dis donc avec les poisons hein) qui s’appelle le tétra-éthyl-ammonium, abrégé TEA. Le TEA bloque les canaux potassiques voltage-dépendant. De manière identique les scientifiques ont appliqué ce poison au neurone et à 0mV, ils ont obtenu le tracé de la courbe 2.
Ce qu’on remarque c’est qu’en présence de tétrodotoxine il y a perte du courant entrant négatif au début mais conservation du courant sortant positif à la fin (on reste au-dessus de 0). Comme le tétrodotoxine inhibe les canaux sodiques voltage-dépendant on peut faire l’hypothèse que l’entrée de cations est en fait une entrée de sodium, qui est donc responsable de la dépolarisation.
En présence de TEA c’est l’inverse, il y a conversation du courant entrant négatif au début mais perte du courant sortant positif à la fin (on reste sous 0). Comme le TEA inhibe les canaux potassiques voltage-dépendant on peut faire l’hypothèse que la sortie de cations est en fait une sortie de potassium, qui est donc responsable de la repolarisation et hyperpolarisation.
L’équation est donc résolue mais j’espère que vous avez compris le principe de ces expériences et la beauté du raisonnement (v’la l’autre avec ses grands mots  ) car apprendre pour apprendre de façon bête et méchante ce n’est pas la meilleure solution en biologie.
) car apprendre pour apprendre de façon bête et méchante ce n’est pas la meilleure solution en biologie.
On en est donc là : dépolarisation = entrée de sodium, repolarisation et hyperpolarisation = sortie de potassium.
Le message électrique progresse dans l’axone sous forme d’un potentiel d’action
Et donc dans tout cela, quel rapport avec la rigidité cadavérique déjà ? Ah oui nous vous expliquions comment le message nerveux arrivait au muscle pour le contracter, en temps normal déjà (de notre vivant).
Le message nerveux se propage donc sous la forme d’un potentiel d’action, le long de l’axone d’un neurone du cortex cérébral, pour arriver jusqu’à la moelle épinière.
Dans cet axone il y a donc propagation du potentiel d’action, de proche en proche, sur une assez longue distance quand même mais rapidement, vous n’attendez pas 10 secondes pour pouvoir bouger votre bras, c’est quasi-instantané !
Il y a donc mouvement d’ions dans cet axone, et de proche en proche le schéma suivant se répète : entrée de sodium, sortie de potassium, entrée de sodium, sortie de potassium etc.
Mais si vous avez bien suivi il y a quand même un gros problème dans tout cela… Vous ne voyez pas ? Non toujours pas ?
Nous vous avions dit que le canaux sodique, étant voltage-dépendant, n’est pas ouvert à -60mV, potentiel de repos du neurone cortical. Mais alors qu’est-ce qui l’ouvre ? Parce qu’il faut bien une première entrée de sodium avant que le message se propage de proche en proche, tout a un début…
Dans la technique de voltage-clamp les scientifiques se sont placés à 0mV pour ouvrir les canaux sodiques et potassiques. Mais in-vivo, dans notre corps, quel est l’élément déclencheur qui ouvre le premier canal sodique voltage-dépendant ?
En fait rappelez-vous des dendrites. Elles reçoivent des informations de nombreux autres neurones et font synapse avec eux, l’information électrique du neurone précédent est transformé en une information chimique dans cette synapse et des récepteurs des dendrites du neurone suivant captent ces molécules chimiques, il y a alors formation du message électrique dans le neurone suivant. C’est le principe ! Notre neurone du cortex cérébral, il a son corps cellulaire avec ses dendrites dans le cortex cérébral, il reçoit des informations d’autres neurones en permanence, et quand vous décidez de bouger vous activez des neurones qui iront communiquer avec ce neurone cortical, ce dernier sera donc activé et au niveau du corps cellulaire des canaux ioniques sont aussi présents, permettant de ne plus être à -60mV mais à -40mV par exemple, au niveau de notre premier canal sodique voltage-dépendant du début de notre axone ! La boucle est bouclée, étant à -40mV au niveau du début de l’axone, cela est largement suffisant pour ouvrir notre premier canal sodique voltage-dépendant. Néanmoins notez que celui-ci s’ouvre bien avant, vers -50mV (même ordre de grandeur pour les canaux potassiques voltage-dépendant, vers -30mV).
Au niveau des dendrites il ne s’agit pas d’un potentiel d’action mais d’un potentiel post-synaptique (abrégé PPS). Selon que celui-ci inhibe le neurone post-synaptique ou l’active, on distingue respectivement le potentiel post-synaptique inhibiteur (PPSI) : souvent entrée de Cl- dans le neurone post-synaptique et le potentiel post-synaptique excitateur (PPSE) : entrée de Na+ dans le neurone post-synaptique par exemple.
Finalement le neurone post-synaptique recevra des informations de plusieurs autres neurones pré-synaptiques et fera la somme des potentiels post-synaptiques engendrés chez lui. Si un neurone pré-synaptique déclenche un PPSI de 5mV par exemple et que le potentiel de repos du neurone post-synaptique est de -65mV alors le nouveau potentiel sera de -70mV, l’éloignant encore plus du seuil d’activation du canal sodique voltage-dépendant de l’axone. Au contraire si un neurone pré-synaptique déclenche un PPSE de 15mV cela portera le nouveau potentiel d’action du neurone post-synaptique à -50mV, atteignant le seuil d’activation du canal sodique voltage-dépendant, assez pour déclencher le potentiel d’action. Maintenant si deux neurones communiquent dont l’un déclenche un PPSI de 5mV et l’autre un PPSE de 15mV alors le neurone post-synaptique fait la somme et le potentiel membranaire résultant sera ici de -55mV, pas assez pour déclencher le potentiel d’action. Le raisonnement est le même pour 3 neurones, 4, 5, 10 000, 1 million…
Ainsi les canaux ioniques des dendrites du neurone post-synaptique ne sont pas voltage-dépendants puisque leur mode d’ouverture est conditionné par la réception de molécules chimiques dans la synapse, ils sont appelés des récepteurs-canaux puisque faisant office à la fois de canaux ioniques et récepteurs des molécules chimiques présentes dans la synapse.
Finalement le potentiel d’action naît au début de l’axone, dans une zone appelée zone gâchette et se propage de proche en proche jusqu’à l’arborisation terminale de l’axone.
Sa propagation est accélérée par la présence d’une gaine de myéline. À la fin de chaque potentiel d’action on aura alors plus de sodium à l’intérieur de la cellule qu’au début et plus de potassium à l’extérieur de la cellule qu’au début. Cela n’est pas souhaitable car rappelez-vous que nous vous avions bien précisé, au début de ce chapitre, qu’il y a toujours plus de potassium dans la cellule qu’à l’extérieur et plus de sodium à l’extérieur de la cellule qu’à l’intérieur. Si on laisse faire, au fur et à mesure des potentiels d’action, on va se retrouver avec une égalisation des concentrations de part et d’autre de la cellule. Et si on a ça bah c’est la mort ! C’est un peu précoce et embêtant car nous n’avons pas prévu d’introduire la rigidité cadavérique pour tout de suite. 
La vie c’est donc le déséquilibre ionique. C’est pour cela qu’un autre acteur intervient peu après chaque potentiel d’action (et même au repos vous allez voir pourquoi). Il s’agit de la pompe Na+/K+ ATPase.
Oulala mais c’est quoi ce nom horrible ? La pompe quoi ?
Il en jette ce nom hein ? 
Tout d’abord un peu de vocabulaire. "Pompe" renvoie à l’idée de "pomper, diriger quelque chose contre, forcer, utiliser de l’énergie", contrairement à "canaux ioniques" où vous devez retenir que cela se fait en douce, dans la joie et la bonne humeur, sans forcer. Où voulons-nous en venir ? Le sens de mouvement d’un ion se fait spontanément de l’endroit où il est le plus concentré vers l’endroit où il est le moins concentré. Une image pour retenir cela est que si nous nous battons à 10 contre 1 nous sommes sûrs de gagner (enfin normalement  ). Donc cela va se faire comme sur des roulettes, nous n’allons pas avoir à nous fatiguer pour gagner. C’est pareil pour les ions ! Il y a plus de potassium à l’intérieur de la cellule qu’à l’extérieur, or nous avons vu que le potassium sortait de la cellule au cours du potentiel d’action, donc il passe de l’endroit où il est le plus concentré vers l’endroit où il est le moins concentré, cela ne pose aucun problème, ce transport se fait sans énergie, il est appelé un transport passif (passif car n’utilise pas d’énergie). On classe les transports passifs en deux catégories : la diffusion simple (passage directement à travers la membrane) et la diffusion facilitée (emprunte une protéine transmembranaire, comme nos canaux ioniques), c’est donc un transport passif par diffusion facilitée ici.
). Donc cela va se faire comme sur des roulettes, nous n’allons pas avoir à nous fatiguer pour gagner. C’est pareil pour les ions ! Il y a plus de potassium à l’intérieur de la cellule qu’à l’extérieur, or nous avons vu que le potassium sortait de la cellule au cours du potentiel d’action, donc il passe de l’endroit où il est le plus concentré vers l’endroit où il est le moins concentré, cela ne pose aucun problème, ce transport se fait sans énergie, il est appelé un transport passif (passif car n’utilise pas d’énergie). On classe les transports passifs en deux catégories : la diffusion simple (passage directement à travers la membrane) et la diffusion facilitée (emprunte une protéine transmembranaire, comme nos canaux ioniques), c’est donc un transport passif par diffusion facilitée ici.
Idem pour le sodium, il entre dans la cellule au cours du potentiel d’action, donc passe de l’endroit où il est le plus concentré vers l’endroit où il est le moins concentré, c’est toujours du transport passif sans utilisation d’énergie.
Là où les choses se compliquent c’est pour réinjecter du potassium à l’intérieur de la cellule après un potentiel d’action et rejeter du sodium vers l’extérieur de la cellule, sinon il y aurait équilibre des concentrations et on ne veut surtout pas de ça nous vous avions dit !
Dans ce cas le potassium passerait du milieu où il est le moins concentré vers le milieu où il est le plus concentré, pareil pour le sodium, PROBLÈME !
C’est là toute l’utilité de notre pompe, en utilisant de l’énergie qui vient d’une molécule dont vous avez déjà peut-être entendu parlé, elle va pouvoir assurer ce transport "contre-nature", on dit que les ions seront transportés contre leur gradient de concentration. Avec les canaux ioniques ils étaient transportés selon leur gradient de concentration.
La pompe Na+/K+ ATPase est alors une forme de transport actif, elle utilise l’énergie d’une molécule appelée l’ATP pour assurer ce transport. Elle transporte 3 ions sodium vers l’extérieur de la cellule contre seulement 2 ions potassium vers l’intérieur de la cellule, cette inégalité des charges positives transportées est à l’origine de la création d’un petit courant par la pompe, mais il est négligeable dans le fait que l’intérieur des cellules soit chargé négativement au proche de la membrane, cela est surtout dû à la présence de "canaux de fuite" et d’anions organiques dans la cellule.
Un canal de fuite est un canal ionique toujours ouvert (et donc ça fuite), au repos le canal de fuite au potassium est plus ouvert que celui du sodium, cela explique en partie aussi les -60mV.
Ainsi grâce à l’action de la pompe, on aura toujours plus de potassium à l’intérieur de la cellule qu’à l’extérieur et toujours plus de sodium à l’extérieur de la cellule qu’à l’intérieur. Ce déséquilibre dans les concentrations en sodium et potassium permettra à son tour aux canaux ioniques, lors des potentiels d’action, de laisser sortir le potassium et entrer le sodium.
Ce n’est pas l’ensemble de l’axone qui se dépolarise au même moment mais cela se fait bien de proche en proche. Quand un potentiel d’action est passé, la membrane se repolarise immédiatement derrière.
Arrivé au bout de l’axone, la dépolarisation permet l’ouverture d’un autre type de canal voltage-dépendant, non décrit jusqu’ici encore, appelé canal calcique voltage-dépendant.
Comme son nom l’indique il laisse passer des ions calcium Ca2+.
Il y a plus de calcium à l’extérieur des cellules qu’à l’intérieur. Sur la base de cette simple phrase vous devriez maintenant être capable de me dire dans quel sens se fera le transport de calcium. Si ce n’est pas le cas revoyez bien votre cours.
C’est vers l’intérieur de la cellule en effet. Donc la dépolarisation permettra l’entrée de calcium dans la cellule, or il s’avère que le calcium est nécessaire pour tout ce qui est phénomène de sécrétion.
Une fois que le calcium a fait son boulot, il ressort de la cellule activement par une pompe (car il y en a plus à l’extérieur de la cellule qu’à l’intérieur), cette pompe est appelée PMCA et utilise aussi l’ATP comme source d’énergie.
À l’extrémité de l’axone il y a des vésicules contenant des neurotransmetteurs. Ces neurotransmetteurs sont des molécules chimiques déversées dans la synapse (c’est le phénomène de sécrétion) par exocytose (c’est-à-dire la cellule sort une substance vers la synapse). Ces neurotransmetteurs se retrouvent donc dans la synapse où ils iront se lier aux récepteurs-canaux sur les dendrites du neurone post-synaptique, générant un PPSI ou un PPSE.
La boucle est bouclée ! Nous venons de parcourir tout le neurone depuis le cortex cérébral jusqu’au deuxième motoneurone de la moelle épinière. De la même façon ce motoneurone de la moelle épinière subira un PPSE, pourra activer son premier canal sodique voltage-dépendant, le potentiel d’action se propagera de proche en proche le long de son axone dans le nerf spinal cette fois-ci, et à l’extrémité de l’axone cela ouvrira un canal calcique voltage-dépendant. Il y aura exocytose des vésicules contenant un neurotransmetteur et cette fois-ci synapse avec un muscle qui est l’effecteur terminal : c’est la fameuse jonction neuromusculaire du début de chapitre.
Le neurotransmetteur en jeu entre le motoneurone et le muscle, dans la jonction neuromusculaire, est l’acétylcholine.
Voilà le principe de base de la conduction du message nerveux, c’était bien costaud en tout cas non ? N’hésitez pas à reprendre tout ça à tête reposée si vous n’avez pas bien compris, car la suite s’appuiera largement sur ces notions.
Un petit mot sur le potentiel complexe (ou potentiel global)
Encore un dernier mot sur la conduction du message nerveux dans les nerfs.
Ici nous avons vu la propagation du message nerveux à l’échelle d’un seul neurone, mais un nerf est composé de plusieurs axones de neurones. Ainsi chaque axone du nerf conduit un message nerveux sous forme de potentiels d’action, quelle que soit l’intensité de stimulation, l’amplitude du potentiel d’action est toujours identique (+90mV, voir avant). On dit que le neurone répond à la loi du tout ou rien, c’est-à-dire que soit la stimulation est assez forte pour provoquer un potentiel d’action (activer le premier canal sodique voltage-dépendant, voir PPSE) on parlera de stimulation supraliminaire, soit elle ne l’est pas et le neurone ne répondra pas du tout (en cas de PPSI par exemple). On parlera de stimulation infraliminaire.
Mais alors comment est codé le message nerveux ? C’est-à-dire qu’est-ce qui différencie une faible contraction musculaire d’une plus forte contraction musculaire ?
C’est en fait la fréquence des potentiels d’action (c’est-à-dire le nombre de potentiels d’action déclenchés par unité de temps) au sein de chaque axone du nerf qui détermine la nature du message nerveux (faible/forte contraction) ainsi que le nombre d’axones recrutés dans le nerf, c’est-à-dire actifs, conduisant bien un message nerveux vers le muscle.
Contrairement à l’échelle d’un seul neurone, un nerf peut ne recruter aucun, peu, beaucoup ou l’ensemble des axones qui le constituent. Donc un nerf ne répond pas à la loi du tout ou rien puisqu’en fonction de l’intensité de stimulation (en relation avec le nombre d’axones du nerf recrutés) on recrutera aucun, peu, beaucoup ou tous les axones du nerf. L’enregistrement de l’activité électrique du nerf n’est plus un potentiel d’action mais ce qu’on appelle un potentiel complexe (aussi appelé potentiel global). Sur un tel enregistrement vous pourrez voir qu’on ne débute plus à -60mV comme à l’échelle d’un seul neurone mais à 0mV, cela est tout à fait normal car la microélectrode est située à l’extérieur du nerf (donc la différence de charges est nulle car la comparaison se fait entre les deux mêmes milieux : le milieu extracellulaire), sinon on enregistrerait ce qu’il se passe pour une seule cellule, comme avant quoi.
Le nom de potentiel complexe n’est pas dû au fait que cette notion est difficile à comprendre. 
C’est simplement dû au fait que ce tracé tient compte de l’activité électrique globale du nerf, donc de l’ensemble de ses axones le constituant.
La contraction musculaire : le couplage excitation-contraction
L’excitation
On revient enfin à nos moutons, à nos muscles plutôt !
Donc notre neurotransmetteur, l’acétylcholine, a été libéré, suite à l’arrivée du potentiel d’action dans l’extrémité de l’axone du neurone pré-synaptique, faisant contact avec notre cellule musculaire.
Il doit se fixer sur un récepteur-canal cible de la cellule musculaire, ce récepteur-canal prend le nom de récepteur nicotinique de l’acétylcholine.
Il faut faire attention. Ce nom ne vient pas du fait que le corps humain contiendrait de la nicotine, heureusement d’ailleurs (sauf si vous fumez) ! Mais que ce récepteur-canal est aussi activé par la nicotine. On dit que la nicotine est un agoniste de ce récepteur, car l’activant au même titre que l’acétylcholine in-vivo. Un antagoniste de ce récepteur, au contraire, l’inhiberait et bloquerait la transmission de l’influx nerveux entre le nerf et le muscle, il s’agit ici du curare.
Ce récepteur-canal n’est pas voltage dépendant car il s’ouvre suite à la liaison de l’acétylcholine, un peu comme pour les dendrites des neurones finalement, sauf qu’ici on est sur une cellule musculaire.
Lorsque ce récepteur-canal s’ouvre il laisse entrer du sodium dans la cellule musculaire. Comme pour le neurone cela dépolarise la membrane de la cellule musculaire, on parle de potentiel d’action musculaire ou de potentiel de plaque motrice (PPM).
Il s’ensuit que cette dépolarisation se transmet de proche en proche sur des zones particulières de la membrane plasmique de la cellule, où celle-ci s’invagine, on appelle ces zones des tubules T (tubules transverses).
Au niveau des tubules T devinez quoi ? Qui c’est qu’on trouve ? Des canaux calciques voltage-dépendant ! Et à l’instar de l’extrémité des axones de neurones ils vont s’ouvrir sous le coup de la dépolarisation amorcée, laissant entrer du calcium vers l’intérieur de la cellule.
Ces canaux calciques voltage-dépendants sont aussi appelés DHP-R pour Récepteurs aux DiHydroPyridines.
L’entrée du calcium va permettre la libération d’un second stock de calcium vers l’intérieur de la cellule, ce stock ne vient plus du milieu extracellulaire mais du réticulum sarcoplasmique (l’équivalent du réticulum endoplasmique des autres cellules). En se fixant sur des récepteurs du réticulum appelés Ryr de type 1 (pour récepteurs à la ryanodine), le calcium va permettre le passage du calcium depuis l’intérieur du réticulum sarcoplasmique vers le sarcoplasme.
Dans les cellules striées squelettiques, il y a un lien physique direct entre DHP-R et Ryr1, de sorte que l’ouverture de DHP-R engendre aussi l’ouverture de Ryr1, laissant sortir le calcium vers le sarcoplasme de la cellule. Ce n’est pas le cas dans les cellules cardiaques où DHP-R et Ryr2 ne sont pas couplés physiquement, ici c’est seulement la liaison du calcium venant du milieu extracellulaire qui permet la sortie du calcium du réticulum, par liaison sur les récepteurs Ryr2, on appelle ce phénomène CICR (pour Calcium-Induced Calcium-Release). Puisque littéralement, dans ce cas, c’est le calcium (venu du milieu extracellulaire) qui induit la libération du calcium (du sarcoplasme).
L’entrée de calcium dans la cellule musculaire ne va pas servir à la sécrétion cette fois-ci mais à la contraction de la cellule. Un premier élément indispensable à la contraction musculaire est donc le calcium.
La contraction
Ce calcium va donc amorcer la contraction de la cellule musculaire. Il est désormais temps de vous rappeler de toutes ces histoires de sarcomères et myofilaments du chapitre précédent, c’est là que ça va nous servir !
Au sein du sarcomère, et plus précisément de la bande A et de la zone où les deux types de myofilaments coexistent, les têtes de myosine ne peuvent se lier à l’actine au repos, c’est-à-dire en absence de calcium dans le sarcoplasme, ou quand il y en a peu. Or la contraction du sarcomère, et donc de la cellule musculaire, nécessite la liaison entre les têtes de myosine et l’actine. En effet, au repos, un complexe moléculaire empêche l’interaction entre les têtes de myosine et le site de fixation pour la myosine situé sur l’actine. Ce complexe est constitué de troponines à 3 sous-unités : la troponine T, la troponine I et la troponine C ainsi que d’une autre molécule appelée la tropomyosine.
Au repos la troponine T, liée à la tropomyosine, fait occuper par cette dernière les sites de fixation de la myosine situés sur l’actine, rendant impossible toute association entre l’actine et les têtes de myosine. La troponine I liée à l’actine renforce ce blocage.
Mais lors d’une contraction, le calcium libéré dans le sarcoplasme peut se fixer sur la troponine C (C comme calcium), cela provoque un changement de conformation du complexe moléculaire et la tropomyosine se détache de l’actine, rendant le site de fixation pour la myosine disponible.
Cela est schématisé ci-dessous :
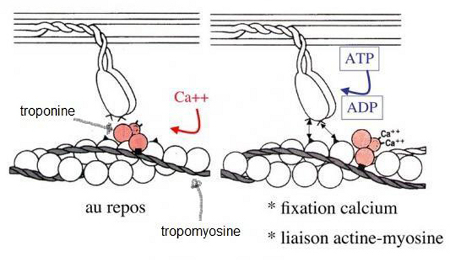
Les "boules blanches" c’est l’actine, les deux têtes en haut du schéma ce sont les têtes de myosine. Les 3 "boules roses" constituent le complexe de troponine, le calcium se liant à la troponine C.
Finalement quand le site de liaison est disponible, la tête de myosine interagit avec l’actine et tire l’actine vers le centre du sarcomère, soit vers la bande H. Les myofilaments fins coulissent et glissent mais ne changent pas de longueur durant la contraction de la cellule musculaire, ils ne sont pas plus courts !
Simplement la longueur de la bande H se réduit puisque les myofilaments fins rejoignent le centre du sarcomère et occupent plus d’espace au sein de la bande A.
Ce n’est pas fini, il y a ce qu’on appelle un cycle de contraction dans la cellule, et l’élément indispensable est l’ATP : ainsi le deuxième élément nécessaire pour la contraction musculaire, en plus du calcium, est l’ATP, fournissant l’énergie.
Au repos la tête de myosine comporte un site d’attache à l’ADP et au Pi (Phosphate Inorganique). Elle est disposée perpendiculairement (à 90°) par rapport à sa queue de myosine. Lorsque la tête de myosine peut interagir avec l’actine, lors d’une contraction, l’ADP et le Pi se détachent de la tête de myosine, celle-ci change alors de conformation et est disposée à 45° par rapport à la queue de myosine. Le passage de 90° à 45° tout en étant lié à l’actine est évident, c’est bien ce mouvement qui entraîne l’actine et le tire vers le centre du sarcomère, responsable de la contraction de la cellule musculaire. Quand c’est fini, il faut une molécule d’ATP qui se lie à la tête de myosine, cela permet son détachement de l’actine et l’hydrolyse de l’ATP en ADP + Pi permettra le retour au début du cycle de contraction, la tête de myosine retrouvant une conformation de 90° par rapport à sa queue et donc capable de lier efficacement l’actine, quand ce sera à nouveau possible (nouvelle contraction).
Retenez bien qu’il faut de l’ATP pour détacher la tête de myosine de l’actine et donc stopper la contraction de la cellule musculaire, c’est primordial pour expliquer la rigidité cadavérique et nous touchons au but, sans ATP pas d’arrêt de la contraction musculaire ! Si vous êtes un peu malin vous pouvez déjà commencer à déduire des choses sur la nature de ce phénomène. 
Pour résumer le cycle de contraction (ce qu’on vient de dire), voici une image en anglais :
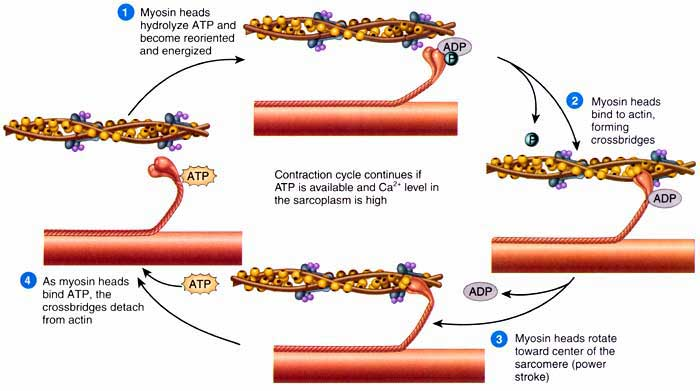
Quand la contraction sera terminée et que le calcium ne sera donc plus nécessaire, il sera repompé vers l’intérieur du réticulum sarcoplasmique de manière active via une pompe appelée SERCA, utilisant là encore l’ATP comme source d’énergie. Ce point est également important pour expliquer le phénomène de rigidité cadavérique.
Finalement quel lien y’a-t-il entre contraction d’un sarcomère, d’une cellule musculaire et de l’ensemble d’un muscle ?
En réalité dans la cellule tous les sarcomères se contractent, il en résulte donc à plus grande échelle la contraction de la cellule entière. Si un grand nombre de cellules se contractent, alors à plus grande échelle c’est le muscle qui se contractera, selon un des deux types de contraction.
Ouf c’est fini ! Long chapitre hein ?
On touche au but de cette première partie, nous allons expliquer le phénomène de rigidité cadavérique avec tout ce qu’on a pu apprendre, et vous verrez que tout ce qu’on a appris a un lien logique, en comprenant ce lien vous serez plus à même de retenir toutes ces nouvelles notions et pour cela rien de mieux qu’un exemple concret de la vie (ou de la mort ici plutôt  ).
).
Ensuite nous vous proposons quelques petits exercices pour mettre le tout en pratique, voir si vous avez compris tout ce que nous vous avons raconté depuis le début.
Nous vous avons mis le plus important de ce chapitre.
L’information de contraction volontaire d’un muscle est un message nerveux qui débute du cortex cérébral jusqu’à la moelle épinière de la partie controlatérale du corps. À ce niveau, dans une synapse entre deux neurones, il y a transformation du message nerveux en message chimique pour être recapté en message nerveux par le motoneurone de la moelle épinière. Ce dernier ira jusqu’à sa cible musculaire. La libération d’acétylcholine dans la jonction neuromusculaire permettra de déclencher un potentiel d’action musculaire, responsable de l’augmentation de la concentration intracellulaire en calcium et permettant la contraction de la cellule musculaire et donc du muscle dans son ensemble ensuite.