Bonjour à tous,
Comme vous le savez, les scientifiques publient sans cesse leurs résultats dans des revues plus ou moins spécialisées. Je passe en revue une vingtaine de revues de chimie en ligne quasi-quotidiennement et me suis dit qu'il serait intéressant de partager sur ZdS quelques articles, de temps à autre.
Voilà donc un petit topic pour le faire. N'hésitez pas à commenter et discuter, ou proposer une trouvaille, à condition que ce soit du tout frais. 
Table des matières:
| Sujet | Date de publi sur ZdS |
|---|---|
| Wikipedia Chemical Structure Explorer | 22 mars 2015 |
| Fluorination décarboxylative | 29 avril 2015 |
| Énantioinversion | 25 août 2015 |
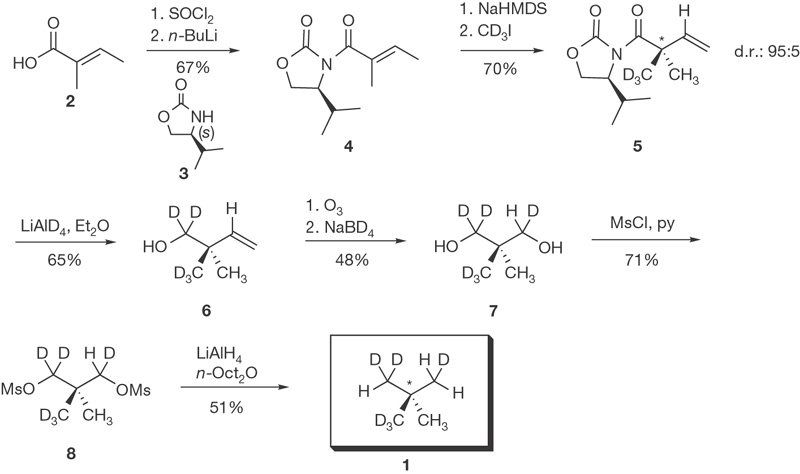
| Neopentance chiral | 14 octobre 2015 |
Wikipedia chemical structure explorer
Voilà quelque chose qui manquait: un moteur de recherche de molécules pour Wikipédia!
Dans un article publié aujourd'hui dans la revue Journal of Cheminformatics, les auteurs présentent un moteur de recherche dans lequel on peut dessiner une molécule (ou fragment) et obtenir en retour toutes les pages dans Wikipédia qui la contiennent!
Le tout a été développé en JavaScript et est disponible sur GitHub. Pour l'essayer, rendez-vous ici.
L'article est très intéressant: ils y expliquent comment ils ont extrait "toutes" les molécules présentes dans Wikipédia (>13'000), comment ils ont par la même occasion trouvé beaucoup de SMILES erronés et les ont corrigés, quels sont les fragments les plus courants, etc.!

Bonne lecture!


 (quand j'aurais le temps, je forkerai le GitHub et je tenterai en local).
(quand j'aurais le temps, je forkerai le GitHub et je tenterai en local).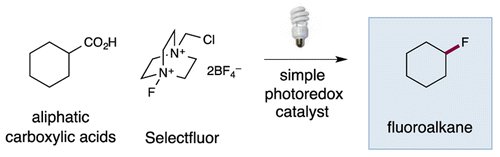
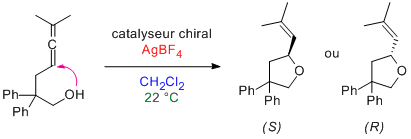
 Ils ne publient jamais les ratés. Sympa comme toujours merci Mathiasm
Ils ne publient jamais les ratés. Sympa comme toujours merci Mathiasm 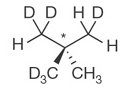




 Hâte que tu me montre tout ça !
Hâte que tu me montre tout ça !